УЧИМСЯ ВМЕСТЕ - ХИМИЯ
|
Меню сайта
Статистика
|
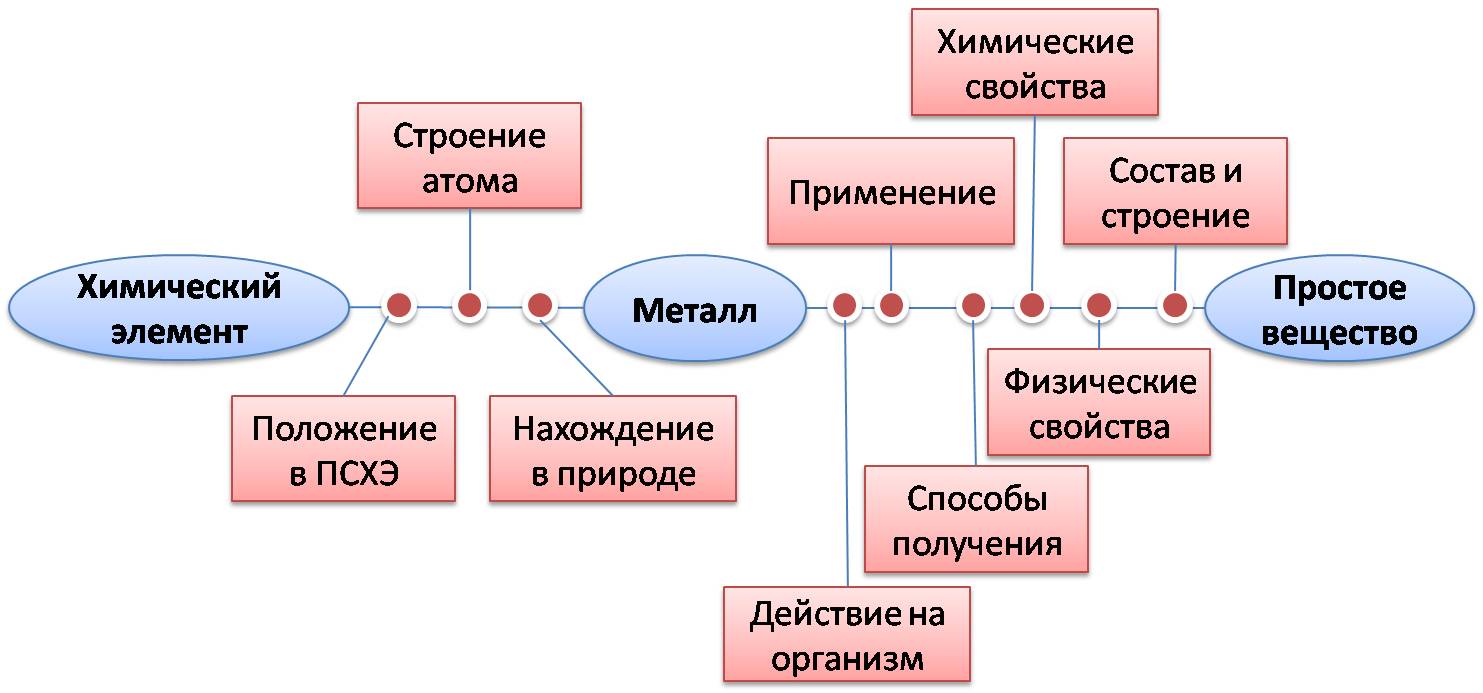
МеталлыОбщая характеристика металлов В химии сложность вызывает оперирование понятиями "простое вещество" и "химический элемент". Для разведения этих понятий воспользуйтесь моделью:
В каталоге файлов можно скачать презентацию о металлах и познакомиться с такими вопросами как: положение металлов в ПСХЭ Д.И. Менделеева,особенности строения атомов, закономерности изменение строения и свойств атомов металлов в группах и периодах, особенности строения простых веществ металлов и их физические свойства, аллотропные модификации некоторых металлов. Металлы IА подгруппы ПСХЭ Д.И. Менделеева - щелочные металлы
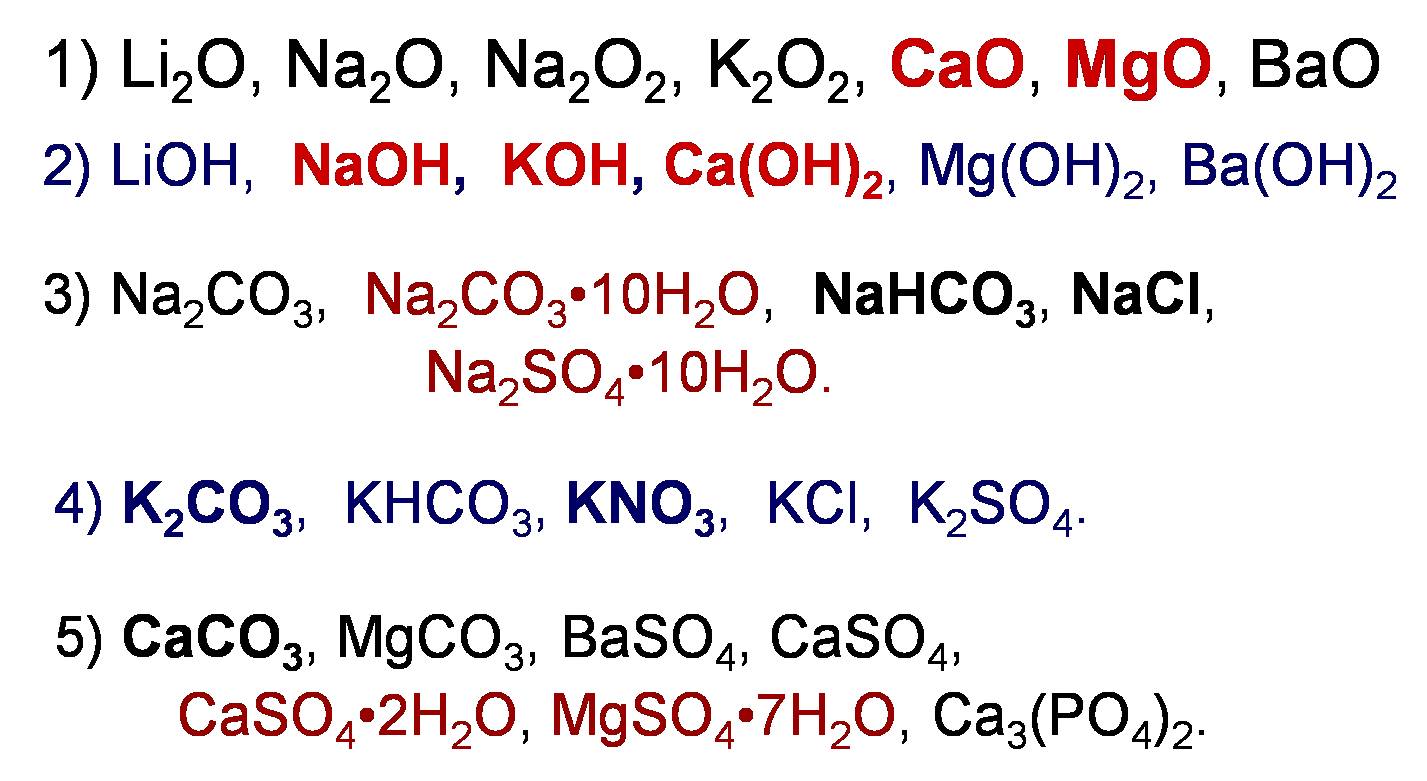
Изучить материал можно по ссылке. Металлы IIА подгруппы ПСХЭ Д.И. Менделеева Многие соединения металлов IA- и IIА-подгрупп широко используются человеком и имеют технический названия. Для веществ выделенных в каждой группе укажите их.
САЙТ ПРО АЛЮМИНИЙ Из истории открытия Немецкий учёный Ф. Велер (1827 г.) получил алюминий при нагревании хлорида алюминия со щелочными металлами калий и натрий. А.Сент-Клер Девиль впервые получил алюминий промышленным способом (1855г.). В период
открытия алюминия - металл был дороже золота. Англичане хотели почтить богатым
подарком великого русского химика Д.И Менделеева, подарили ему химические весы,
в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из
алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не
только учёных, но и промышленников и даже императора Франции. Физические свойства Алюминий – металл серебристо-белого цвета, лёгкий (р-2,7г/см3), плавится при
температуре 660°С обладает
хорошей ковкостью, пластичностью, электрической проводимостью и
теплопроводностью, легко поддается обработке, образует лёгкие и прочные сплавы. Химические свойства Алюминий восстанавливает
все элементы, находящиеся справа от него в электрохимическом ряду
напряжения металлов, простые вещества – неметаллы. Из сложных соединений
алюминий восстанавливает ионы водорода и ионы менее активных металлов.
Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку
его поверхность покрыта защитной оксидной плёнкой.
Соединения алюминия
Вывод: облагодаря такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл широкое применение в авиационном и космическом транспорте; во многих отраслях народного хозяйства. Особое место алюминий и его сплавы, электротехнике, а за ними будущее нашей науки и техники. Генетический ряд алюминия Железо и медь - металлы побочных подгрупп ПСХЭ Д.И. Менделеева Химические свойства железа На воздухе в присутствии влаги железо ржавеет: 4Fе + 3O2 + 6Н2О = 4Fе(ОН)3. С галогенами оно образует галогениды железа (III) 2Fе + 3Вr2 = 2FеВr3, а взаимодействуя с соляной и разбавленной серной кислотами — соли железа (II): Fе + Н2SО4 = FеSО4 + Н2↑. Концентрированные кислоты — окислители (НNО3, Н2SО4) пассивируют железо на холоде, однако растворяют его при нагревании: 2Fе + 6Н2SО4(конц) = Fе2(SО4)3 + 3SО2↑ + 6Н2О, Fе + 6НNО3(конц) = Fе(NО3)3 + 3NО2↑ + 3Н2О. Соединения железа Растворимые соли железа в воде гидролизуются и дают кислую реакцию, поскольку гидроксиды железа (II) и (III) в воде не растворимы. Гидроксид железа (II) получают действием раствора щелочи на соли железа (II) без доступа воздуха: FеSО4 + 2NaОН = Fе(ОН)2↓ + Na2SО4. Fе(ОН)2 — осадок белого цвета; в присутствии воздуха он зеленеет и быстро превращается в гидроксид железа (III) (бурый осадок): 4Fе(ОН)2 + O2 + 2Н2О = 4Fе(ОН)3. Гидроксид железа (III), в отличие от Fе(ОН)2, амфотерен, при нагревании он способен растворяться в щелочах с образованием гексагидроферрата (III): Fе(ОН)3 + 3КОН = К3[Fе(ОН)6] Это — один из анионных комплексов железа (III). Отметим еще две важные комплексные соли железа: гексацианоферрат (II) калия К4[Fе(СN)6] (желтая кровяная соль) и гексацианоферрат (III) калия К3[Fе(СN)6] (красная кровяная соль), являющиеся реактивами для качественного определения ионов Fе3+ и Fe2+ соответственно. Добавление раствора гексацианоферрата (II) к растворам, в которых содержатся ионы железа (III), вызывает образование темно-синего осадка, часто называемого берлинской лазурью: 4К4[Fе(СN)6] + 4Fе3+ = 4КFеIII[FеII(СN)6]↓ + 12К+. (*) Такой же темно-синий осадок образуется при добавлении раствора гексацианоферрата (III) к растворам, содержащим ионы железа (II). В этом случае осадок называется турнбуллевой синью: 3К3[Fе(СN)6] + 3Fе2+ = 3КFеII[FеIII(СN)6]↓ + 6К+. (**) Установлено, что берлинская лазурь и турнбуллева синь — это одно и то же вещество, так как комплексы, образующиеся в реакциях (*) - (**) находятся между собой в равновесии. Красная кровяная соль и желтая кровяная соль являются реактивами на ионы железа (II) и (III) соответственно. Ион железа (III) можно обнаружить реакцией с растворимыми солями тиоциановой (роданистоводородной) кислоты HNCS - тиоцианатами (роданидами), например, KNCS и др. Ионы железа Fе3+ связываются с ионами NCS- соли с образованием растворимой, но малодиссоциирующей соли Fе(NCS)3 , имеющей кроваво-красный цвет: Fе3+ + 3NCS- = Fе(NCS)3 Генетические ряды железа (II) и железа (III) Медь. Взаимодействие с кислотами. Медь — довольно мягкий металл красно-желтого цвета, обладающий наименьшей активностью среди рассмотренных выше переходных металлов, которые вытесняют медь из растворов ее солей. Медь не реагирует с соляной и разбавленной серной кислотами и растворяется только в кислотах — окислителях: Сu + 2Н2SО4(конц) = СuSО4 + SО2↑ + 2Н2О, Сu + 4НNO3(конц) = Сu(NО3)2 + 2NО2↑ + 2Н2О, 3Cu + 8НNО3(разб) = 3Сu(NO3)2 + 2NO↑ + 4Н2О. Генетический ряд меди Реакции обнаружения катионов металлов Источник интерактивных заданий - http://school-collection.edu.ru/ |
Поиск
Архив записей
Наш опрос
Алхимик
Химия и жизнь
ФИПИ
|
|||||||||||||||||||||||||||||||||||||||||||||||