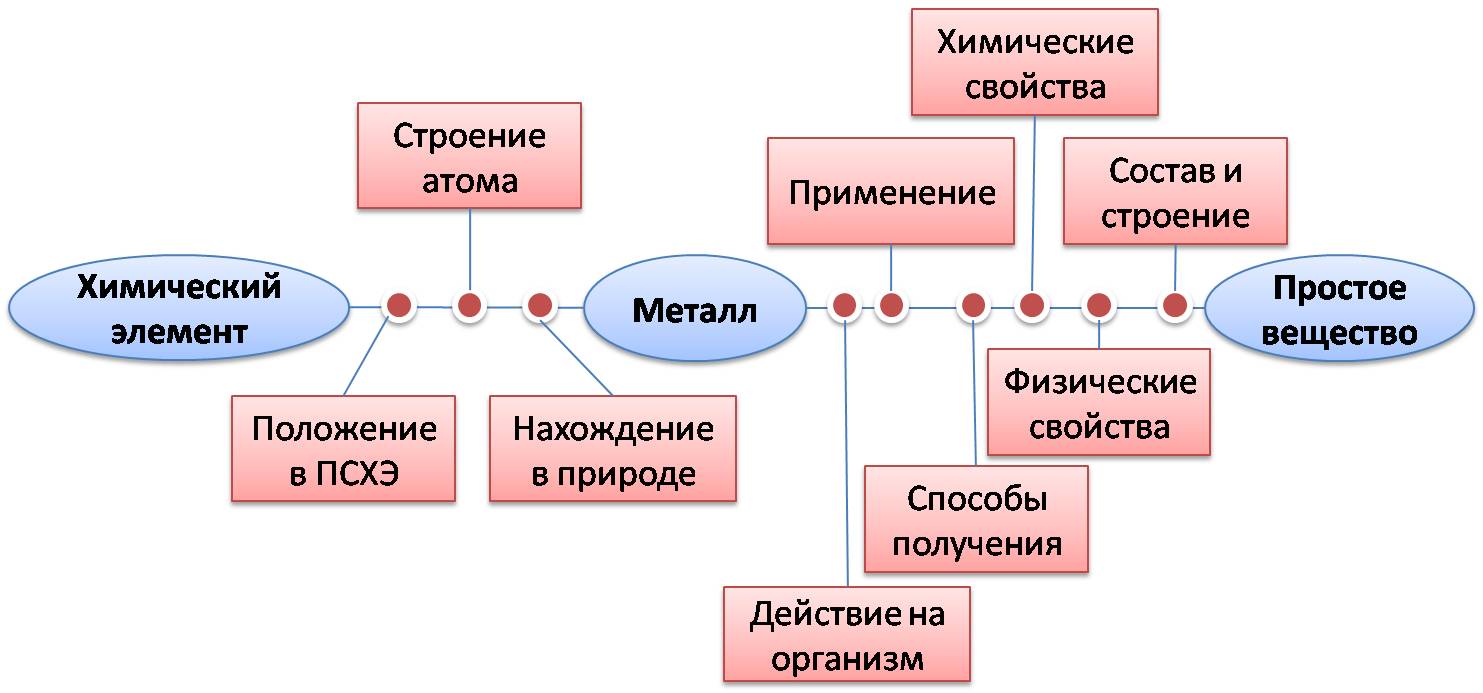
 |
| К щелочным металлам относятся элементы первой группы, главной подгруппы: литий, натрий, калий, рубидий, цезий, франций. |
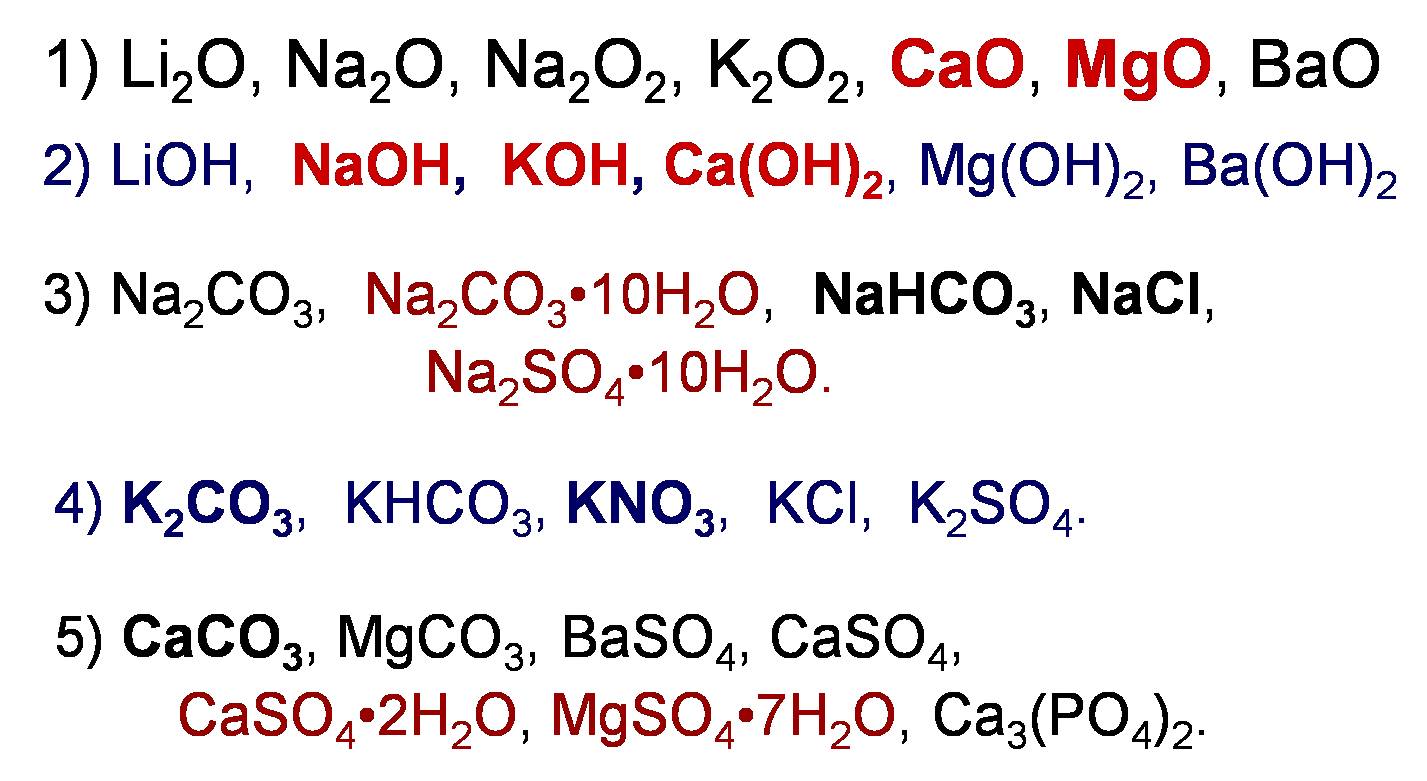 |
| 1. С кислородом | 4Al+3O2=2Al2O3 |
| 2. С галогенами | 2Al+3Cl2=2AlCl3 |
| 3. С серой при нагревании | 2Al+3S=Al2S3 |
| 4.С углеродом | 4Al+3C=Al4C3 |
| 5. Алюминотермия | 8Al+3Fe3O4=4Al2O3+9Fe |
| 6. С водой (после разрушения оксидной пленки) | 2Al+6H2O=2Al(OH)3+3H2 |
| 7. Растворяется в щелочах | 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2 |
| 8. Реагирует с кислотами | 2Al+6HCl=2AlCl3+3H2 |
| 9. С азотной и концентрированной серной кислотами на холоду не реагируют. При нагревании: | Al+6H2SO4(конц.)=Al2(SO4)3+3SO2 Al+6HNO3=Al(NO3)3+3NO2 |
Оксид алюминия Al2O3 - очень твердый (корунд, рубин), тугоплавкий - 2050°С. Не растворяется в воде. Получение: 2Al(OH)3=Al2O3+3H2O Свойства: амфотерный оксид Al2O3+6HCl=2AlCl3+3H2OAl2O3+2NaOH+3H2O=2Na[Al(OH)4] Для перевода в растворимое состояние используют сплавление: Al2O3+2NaOH=2NaAlO2 (метаалюминат) | Гидроксид Al(OH)3 Получение: AlCl3+3(NH3·H2O)=Al(OH)3 Свойства: амфотерное основание Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=Na[Al(OH)4] |
| Многие соли хорошо растворимы в воде , они гидрализуются( кислая реакция): Al3++H2O |
Соединения железа
Растворимые соли железа в воде гидролизуются и дают кислую реакцию, поскольку гидроксиды железа (II) и (III) в воде не растворимы.
Гидроксид железа (II) получают действием раствора щелочи на соли железа (II) без доступа воздуха:
FеSО4 + 2NaОН = Fе(ОН)2↓ + Na2SО4.
Fе(ОН)2 — осадок белого цвета; в присутствии воздуха он зеленеет и быстро превращается в гидроксид железа (III) (бурый осадок):
4Fе(ОН)2 + O2 + 2Н2О = 4Fе(ОН)3.
Гидроксид железа (III), в отличие от Fе(ОН)2, амфотерен, при нагревании он способен растворяться в щелочах с образованием гексагидроферрата (III):
Fе(ОН)3 + 3КОН = К3[Fе(ОН)6]
Это — один из анионных комплексов железа (III).
Отметим еще две важные комплексные соли железа: гексацианоферрат (II) калия К4[Fе(СN)6] (желтая кровяная соль) и гексацианоферрат (III) калия К3[Fе(СN)6] (красная кровяная соль), являющиеся реактивами для качественного определения ионов Fе3+ и Fe2+ соответственно.
Добавление раствора гексацианоферрата (II) к растворам, в которых содержатся ионы железа (III), вызывает образование темно-синего осадка, часто называемого берлинской лазурью:
4К4[Fе(СN)6] + 4Fе3+ = 4КFеIII[FеII(СN)6]↓ + 12К+. (*)
Такой же темно-синий осадок образуется при добавлении раствора гексацианоферрата (III) к растворам, содержащим ионы железа (II). В этом случае осадок называется турнбуллевой синью:
3К3[Fе(СN)6] + 3Fе2+ = 3КFеII[FеIII(СN)6]↓ + 6К+. (**)
Сu + 2Н2SО4(конц) = СuSО4 + SО2↑ + 2Н2О,
Сu + 4НNO3(конц) = Сu(NО3)2 + 2NО2↑ + 2Н2О,
3Cu + 8НNО3(разб) = 3Сu(NO3)2 + 2NO↑ + 4Н2О.